МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ'Я УКРАЇНИНАКАЗЗареєстровано в Міністерстві юстиції України
24 грудня 2024 р. за N 1990/43335
Про затвердження Порядку обліку, зберігання, транспортування біологічно патогенних агентівВідповідно до абзацу шістнадцятого пункту 20 частини першої статті 8 Закону України "Про систему громадського здоров'я", пункту 8 Положення про Міністерство охорони здоров'я України, затвердженого постановою Кабінету Міністрів України від 25 березня 2015 року N 267 (в редакції постанови Кабінету Міністрів України від 24 січня 2020 року N 90), з метою регламентації питань обліку, зберігання та транспортування біологічно патогенних агентів НАКАЗУЮ: 1. Затвердити Порядок обліку, зберігання, транспортування біологічно патогенних агентів, що додається. 2. Департаменту громадського здоров'я (Тетяні Скапі) забезпечити: 1) подання цього наказу в установленому законодавством порядку на державну реєстрацію до Міністерства юстиції України; 2) оприлюднення цього наказу на офіційному вебсайті Міністерства охорони здоров'я України після здійснення державної реєстрації в Міністерстві юстиції України. 3. Контроль за виконанням цього наказу покласти на заступника Міністра охорони здоров'я України - головного державного санітарного лікаря України Ігоря Кузіна. 4. Цей наказ набирає чинності з дня його офіційного опублікування. Міністр | Віктор ЛЯШКО | ПОГОДЖЕНО: | | Віце-прем'єр-міністр
з відновлення України - Міністр
розвитку громад та територій України | Олексій КУЛЕБА | Виконуючий обов'язки Міністра
аграрної політики та
продовольства України | Тарас ВИСОЦЬКИЙ | Міністр захисту довкілля
та природних ресурсів України | Світлана ГРИНЧУК | Голова Державної
прикордонної служби України | Сергій ДЕЙНЕКО | Голова Державної служби України
з питань безпечності харчових
продуктів та захисту споживачів | Сергій ТКАЧУК | Уповноважений Верховної
Ради України з прав людини | Дмитро ЛУБІНЕЦЬ | Голова Національної
поліції України | Іван ВИГІВСЬКИЙ | В. о. Президента Національної
академії аграрних наук України | Ігор ГРИНИК | Віцепрезидент Національної
академії наук України
академік НАН України | Вячеслав КОШЕЧКО | Голова Державної служби
України з надзвичайних ситуацій | Андрій ДАНИК | Голова Державної
регуляторної служби України | Олексій КУЧЕР |
ЗАТВЕРДЖЕНО
Наказ Міністерства охорони здоров'я України
04 листопада 2024 року N 1851
Порядок обліку, зберігання, транспортування біологічно патогенних агентівI. Загальні положення1. Цей Порядок визначає процедуру обліку, зберігання, транспортування біологічно патогенних агентів (далі - БПА) на території України. 2. Цей Порядок поширюється на суб'єктів господарювання незалежно від форми власності та підпорядкування, які мають у своїй структурі лабораторії мікробіологічного профілю, та проводять роботи з БПА (далі - лабораторія). 3. Цей Порядок не поширюється на генетично модифіковані організми, живі змінені організми, обіг яких здійснюється згідно з Законом України "Про державну систему біобезпеки при створенні, випробуванні, транспортуванні та використанні генетично модифікованих організмів". 4. У цьому Порядку терміни вживаються в таких значеннях: інфекційні матеріали (речовини) - речовини, про які відомо або є підстави вважати, що вони містять БПА; категорія небезпеки A - інфекційний матеріал, що транспортується у вигляді, в якому він здатен викликати, у разі свого впливу, постійну непрацездатність людини, створити загрозу життю людей та тварин або призвести до їх смертельного захворювання; категорія небезпеки B - інфекційний матеріал, що не відповідає критеріям віднесення до категорії небезпеки A; Інші терміни у цьому Порядку вживаються у значеннях, наведених у Законах України "Про систему громадського здоров'я", "Про захист населення від інфекційних хвороб", "Про перевезення небезпечних вантажів", "Про управління відходами", Державних санітарних правил "Правила влаштування і безпеки роботи в лабораторіях (відділах, відділеннях) мікробіологічного профілю" (ДСП 9.9.5.-080-02), затверджених постановою Головного державного санітарного лікаря України від 28 січня 2002 року N 1, Державних санітарних нормах і правилах "Організація роботи лабораторій при дослідженні матеріалу, що містить біологічні патогенні агенти I - IV груп патогенності молекулярно-генетичними методами", затверджених наказом Міністерства охорони здоров'я України від 24 січня 2008 року N 26, зареєстрованих в Міністерстві юстиції України 07 лютого 2008 року за N 88/14779, Порядку оцінки рівня небезпеки впливу біологічних агентів на працівників, затвердженому наказом Міністерства охорони здоров'я України від 22 лютого 2023 року N 365, зареєстрованому в Міністерстві юстиції України 24 квітня 2023 року за N 652/39708, та інших нормативно-правових актах у сфері охорони здоров'я. 5. Робота з БПА проводиться із дотриманням вимог Законів України "Про ветеринарну медицину", "Про перевезення небезпечних вантажів", "Про державний контроль за дотриманням законодавства про харчові продукти, корми, побічні продукти тваринного походження, здоров'я та благополуччя тварин", ДСТУ 7748:2015 "Безпека праці. Біологічна безпека. Загальні вимоги", прийнятого наказом Державного підприємства "Український науково-дослідний і навчальний центр проблем стандартизації, сертифікації та якості" від 22 червня 2015 року N 61, Державних санітарних правил "Правила влаштування і безпеки роботи в лабораторіях (відділах, відділеннях) мікробіологічного профілю" (ДСП 9.9.5.-080-02), затверджених постановою Головного державного санітарного лікаря України від 28 січня 2002 року N 1. 6. БПА, які становлять або можуть становити небезпеку для здоров'я людини, які виділені в лабораторіях, що не мають права проводити роботи з ними, а також БПА, що вперше виділені на території України та/або атипові штами I - IV груп небезпеки не пізніше трьох календарних днів з моменту виділення передаються до лабораторії головної експертної установи у сфері громадського здоров'я (за умов виділення БПА небезпечних для людей) та/або до лабораторії Держпродспоживслужби (за умов виділення БПА небезпечних для тварин), відповідно до вимог цього Порядку. 7. Ввезення, вивезення або транзитне переміщення через територію України БПА здійснюється з дотриманням вимог національного законодавства, міжнародних вимог щодо транспортування БПА, а також вимог держави, у яку здійснюється перевезення БПА. II. Забезпечення умов безпеки під час зберігання БПА1. БПА зберігаються у спеціально призначених для цього місцях в приміщеннях лабораторій відповідно до вимог ДСТУ 7748:2015 "Безпека праці. Біологічна безпека. Загальні вимоги", прийнятого наказом Державного підприємства "Український науково-дослідний і навчальний центр проблем стандартизації, сертифікації та якості" від 22 червня 2015 року N 61, та Державних санітарних правил "Правила влаштування і безпеки роботи в лабораторіях (відділах, відділеннях) мікробіологічного профілю" (ДСП 9.9.5.-080-20), затверджених постановою Головного державного санітарного лікаря України від 28 січня 2002 року N 1. Будівлі, у яких облаштовано лабораторії, обладнуються системою відеоспостереження, системою протипожежного захисту, системою електронного або механічного допуску для вхідних дверей та знаходяться під цілодобовою охороною. Вікна у відповідних приміщеннях лабораторій мають бути заґратовані. Організовується пропускна система допуску до будівлі, у якій облаштовано лабораторію. 2. До роботи з БПА допускаються працівники лабораторії, що мають відповідну кваліфікацію та пройшли інструктаж з вимог щодо безпечності для здоров'я і життя людини та вимог щодо запобігання неумисному потраплянню людини під дію патогенів і токсинів чи їх випадковому вивільненню при роботі з БПА. Порядок проведення інструктажу затверджується керівником суб'єкта господарювання, у структурі якого функціонує відповідна лабораторія (далі - суб'єкт господарювання). 3. Кожен вид БПА зберігається окремо від інших. Для забезпечення роздільного зберігання різних видів БПА для кожного з них виділяються окремі контейнери або пенали, виготовлені з матеріалів, що стійкі до факторів фізичного, температурного та хімічного впливу. 4. Штами та/або культури зберігають в ампулах, пробірках або флаконах, герметично закритими і з відповідним маркуванням (інвентарний номер, назва штаму, номер пасажу, дата ліофілізації або закладки на зберігання), що унеможливлює переплутування, перехресну контамінацію та витік матеріалу назовні. 5. БПА зберігають в ліофілізованому, замороженому або нативному стані, в залежності від типу чи природи біологічного матеріалу. 6. На БПА (штами та/або культури), що зберігаються в лабораторії або передаються суб'єктом господарювання іншій особі, оформлюється паспорт БПА за формою, наведеною у додатку 1 до цього Порядку. 7. Для реєстрації дій з БПА в лабораторії ведеться така документація (в паперовій або електронній формі): 1) форма облікової статистичної документації, що використовується в санітарно-епідеміологічних закладах, N 275/0 "Журнал реєстрації мікроорганізмів, які надійшли на дослідження (ідентифікацію)", затверджена наказом Міністерства охорони здоров'я України від 11 липня 2000 року N 160; 2) інвентарний журнал обліку БПА за формою, наведеною у додатку 2 до цього Порядку; 3) форма облікової статистичної документації, що використовується в санітарно-епідеміологічних закладах, N 270/0 "Журнал обліку руху заразного матеріалу (мікроорганізмів, токсинів, отрут, взірців з підозрою на зараження)", затверджена наказом Міністерства охорони здоров'я України від 11 липня 2000 року N 160; 4) журнал передачі БПА іншому суб'єкту господарювання за формою, наведеною у додатку 3 до цього Порядку; 5) форма облікової статистичної документації, що використовується в санітарно-епідеміологічних закладах, N 280/0 "Журнал обліку виділених культур та їх знищення", затверджена наказом Міністерства охорони здоров'я України від 11 липня 2000 року N 160; 6) журнал записів результатів перевірки властивостей БПА за формою, наведеною у додатку 4 до цього Порядку. 8. У разі ведення журнала записів результатів перевірки властивостей БПА в паперовій формі кожна його сторінка нумерується, журнал прошнуровується та скріплюється підписом керівника суб'єкта господарювання. 9. Інфекційний матеріал, який не потребує подальшого зберігання, підлягає видаленню відповідно до Закону України "Про управління відходами". Видалення штамів та/або культур супроводжується реєстрацією за формою облікової статистичної документації, що використовується в санітарно-епідеміологічних закладах, N 280/0 "Журнал обліку виділених культур та їх знищення", затвердженою наказом Міністерства охорони здоров'я України від 11 липня 2000 року N 160. 10. За результатом видалення БПА 3, 4 груп небезпеки складається акт за формою, наведеною у додатку 5 до цього Порядку, який підписується завідувачем та працівниками лабораторії, які безпосередньо здійснювали знищення БПА. В акті про знищення БПА обов'язково зазначаються назва БПА, причина та спосіб його знищення. III. Транспортування БПА1. Передача БПА одним суб'єктом господарювання іншому здійснюється за рішенням керівника цього суб'єкта господарювання на підставі письмового запиту за підписом керівника суб'єкта господарювання, що потребує отримання БПА, у якому обов'язково зазначаються відомості: 1) про суб'єкта господарювання, який подає запит; 2) види діяльності лабораторії, що функціонує у його складі; 3) назва БПА та мета їх отримання, види робіт, які планується проводити з відповідними БПА. 2. При передачі БПА складається відповідний акт передачі у двох примірниках у довільній формі. У такому акті передачі зазначаються: 1) назва БПА, кількість відпущених ємностей (ампули, пробірки, флакони) з БПА; 2) умови транспортування; 3) підпис відповідальної особи отримувача БПА, підпис особи, яка видає БПА. 3. Один примірник акта передачі залишається у суб'єкта господарювання, який передає БПА, другий - надається отримувачу БПА. 4. Інфекційний матеріал, що містить БПА, перед транспортуванням та в залежності від категорії, упаковується відповідно до вимог розділів IV, V, VI цього Порядку. 5. Перевезення БПА 3, 4 груп небезпеки з однієї лабораторії в іншу або з місця їх виявлення до лабораторії дозволяється тільки з особою, яка супроводжує БПА. Особа, яка супроводжує БПА, має бути ознайомлена з вимогами щодо перевезення БПА та порядком дій, яких слід дотримуватись у випадку потрапляння БПА в навколишнє природнє середовище під час їх перевезення. 6. Лабораторія, що здійснює передачу БПА, забезпечує дотримання умов пакування, встановлених розділами IV - VI цього Порядку, що дозволяє забезпечити стабільність властивостей БПА та запобігання ненавмисному викиду (розповсюдженню) БПА назовні. 7. Перевезення чистих культур мікроорганізмів, культур клітин, стандартизованих еталонних матеріалів, супроводжується паспортом, що оформлюється відповідно до додатка 1 до цього Порядку. 8. Транспортування БПА здійснюється із дотриманням правил перевезення небезпечних вантажів суб'єктами господарювання, які отримали ліцензію на провадження господарської діяльності з перевезення небезпечних вантажів (клас 6.2 - інфекційні речовини). 9. У разі ввезення на територію України БПА категорії небезпеки A зазначених у додатку 6 до цього Порядку, суб'єкт господарювання, у структурі якого функціонує лабораторія, що їх отримує, не пізніше наступного календарного дня після отримання БПА категорії небезпеки A повідомляє про отримання таких БПА головну експертну установу у сфері громадського здоров'я (у разі отримання БПА, які становлять або можуть становити небезпеку для здоров'я людини) та/або Держпродспоживслужбу (у разі отримання БПА, які становлять або можуть становити небезпеку для здоров'я тварин). 10. Весь персонал суб'єкта господарювання, відповідальний за пакування та транспортування біологічних матеріалів, повинен бути ознайомлений під підпис з вимогами цього Порядку. 11. При транспортуванні інфекційного матеріалу категорії небезпеки A та категорії небезпеки B та з метою збереження їх властивостей, використовуються охолоджуючі речовини, такі як звичайний лід, сухий лід та рідкий азот. Для забезпечення збереження правильного положення внутрішньої тари після того, як охолоджуючі матеріали розморозяться або випаруються, вторинна тара укріплюється в зовнішній тарі. Зразок пакування та маркування інфекційного матеріалу із застосуванням сухого льоду наведено у додатку 9 до цього Порядку. 12. У разі виникнення надзвичайних ситуацій під час транспортування БПА категорії небезпеки A про такі надзвичайні ситуації протягом 24 годин повідомляється головна експертна установа у сфері громадського здоров'я та/або Держпродспоживслужба. Порядок дій у разі виникнення аварійних ситуацій визначений у розділі VII цього Порядку. IV. Загальні вимоги до пакування, маркування та супровідної документації інфекційного матеріалу1. Для всіх категорій інфекційного матеріалу застосовується базовий принцип потрійного пакування (три шари). 2. Потрійне пакування складається з таких шарів: 1) первинна ємність - водонепроникна та герметична ємність, що містить зразок. Ця ємність упаковується в достатню кількість адсорбуючого матеріалу, щоб у разі пошкодження або протікання абсорбувати всю рідину; 2) вторинна тара - водонепроникна, герметична упаковка для того, щоб помістити та захистити первинні ємності. В одну вторинну тару можна помістити кілька обгорнутих первинних ємностей, при цьому слід використовувати достатню кількість абсорбуючого матеріалу, щоб поглинути всю рідину у разі пошкодження чи протікання; 3) зовнішня тара - тара, в яку поміщають вторинну тару для транспортування з достатньою кількістю амортизуючого матеріалу. Зовнішня тара під час транспортування захищає вміст від несприятливих зовнішніх впливів, наприклад, від механічного пошкодження. Мінімальні розміри зовнішньої тари повинні бути не менше ніж 100 х 100 мм. 3. Дозволяється використовувати зовнішню тару лише з міцного матеріалу (картон, пластик, метал, інший матеріал), який пройшов відповідні випробування, такі як намокання, витримування низькою температурою, падіння з висоти 9 м. 4. Відправники інфекційних матеріалів повинні гарантувати, що упаковка зроблена таким чином, що матеріали надійдуть до пункту призначення в непошкодженому стані і не становитимуть небезпеки для людей або тварин під час транспортування. 5. Кожен остаточно упакований вантаж має бути промаркований, забезпечений етикеткою та супровідною документацією відповідно до категорії небезпеки. 6. Якщо при транспортуванні, інфекційний матеріал налічує кілька упаковок і призначений для відправлення в один і той же пункт призначення одним вантажовідправником використовується транспортна тара (зразок пакування та маркування наведений у додатку 10 до цього Порядку). Транспортна тара не є упаковкою зі специфікацією ООН, але має позначку "Внутрішня упаковка відповідає визначеним специфікаціям". Усі маркування та етикетки, що є на внутрішній упаковці, також позначаються і на транспортній тарі. Транспортна тара позначається словами "Транспортна тара" та містить одну або кілька зовнішніх тар та може використовуватися з сухим льодом. V. Вимоги до пакування, маркування та супровідної документації інфекційного матеріалу категорії небезпеки A1. Інфекційний матеріал категорії небезпеки A, позначений під номерами ООН UN 2814 та UN 2900, транспортується за умови потрійного пакування, що відповідає специфікації підкласу 6.2 ООН та вимогам цього Порядку. Перелік інфекційного матеріалу категорії небезпеки A наведено в таблиці додатку 6 до цього Порядку. 2. Первинна ємність та вторинна тара мають бути герметичні та водостійкі. При перевезенні нетвердих інфекційних матеріалів категорії небезпеки A, між первинною ємністю та вторинною тарою розташовується абсорбуючий матеріал у кількості, достатній для поглинання всього вмісту. Якщо в одній вторинній тарі знаходяться декілька первинних ємностей, кожна первинна ємність обгортається окремо або розділяється в окремі вторинні тари, щоб унеможливити контакт між ними. Зразок пакування та маркування інфекційного матеріалу категорії небезпеки A наведено в додатку 7 до цього Порядку. 3. Тверда зовнішня тара має бути достатньо міцна, відповідати об'єму, вазі та характеру вантажу. Мінімальний розмір зовнішньої тари не менше 100 мм. Між вторинною та зовнішньої тарами може розташовуватися сухий лід. 4. Інфекційний матеріал категорії небезпеки A, що транспортується при температурі навколишнього природного середовища або за вищої температури, має бути розміщений у первинну ємність, виготовлену зі скла, металу чи пластику. Для недопущення вивільнення матеріалу з первинної ємності та з метою забезпечення герметичності, застосовуються такі ефективні засоби, як, наприклад, термозварювання, оперізувальні пробки, або металеві обтискні пломби. У разі використання кришок, що нагвинчуються, такі кришки повинні бути додатково закріплені ефективними засобами, наприклад клейкою стрічкою, розплавленим парафіном чи спеціальними замками для пробок. 5. При транспортуванні інфекційного матеріалу категорії небезпеки A в охолодженому чи замороженому вигляді, звичайний лід, сухий лід та інші охолоджуючі елементи розташовуються навколо вторинної тари (вторинних тар) або всередині зовнішньої тари. Для недопущення зміщення вторинної тари (вторинних тар) після розтанення звичайного льоду чи випаровування сухого льоду, застосовуються внутрішні кріплення. При використанні сухого льоду, зовнішня тара обов'язково забезпечує вихід газоподібного двоокису вуглецю (вуглекислого газу), що випаровується. Первинна ємність та вторинна тара зберігають свою цілісність при температурі використовуваної охолоджувальної речовини. 6. Інфекційний матеріал категорії небезпеки A, що транспортується в рідкому азоті, розміщується у первинну ємність, виготовлену з пластмаси, яка здатна витримати дуже низьку температуру. Первинна ємність та вторинна тара мають зберігати свою цілісність при температурі рідкого азоту. 7. У разі транспортування ліофілізованих речовин, первинна ємність представляє собою запаяні ампули чи закриті резиновими пробками скляні флакони, додатково закриті металевими ковпачками. 8. При будь-якому температурному режимі транспортування інфекційного матеріалу категорії небезпеки A первинна ємність або вторинна тара повинні витримують перепад тиску щонайменше 95 кПа (0,95 бар) та зміни температури в діапазоні від -40 C° до +55 C°. 9. На зовнішній тарі наявне маркування з інформацією про вміст вантажу і характер небезпечного матеріалу, а також про дотримані стандарти упаковки. 10. Усі маркування на зовнішній тарі розташовуються таким чином, щоб їх було добре видно і щоб одні маркувальні знаки не були заклеєні іншими етикетками. 11. На зовнішній тарі розміщується така інформація, яка застосовується як для внутрішніх так і для міжнародних перевезень: 1) найменування та адреса суб'єкта господарювання, власне ім'я та прізвище працівника, який безпосередньо здійснює відправку вантажу (відповідальна особа); 2) номер телефону відповідальної особи; 3) найменування та адреса суб'єкта господарювання - одержувача вантажу, а також власне ім'я та прізвище його працівника, який безпосередньо буде здійснювати одержання вантажу (за наявності); 4) номер ООН та належне відвантажувальне найменування (відповідно, UN 2814 "ІНФЕКЦІЙНІ МАТЕРІАЛИ, НЕБЕЗПЕЧНІ ДЛЯ ЛЮДЕЙ"), що вказується під маркувальним знаком "ІНФЕКЦІЙНИЙ МАТЕРІАЛ"; 5) вимоги до температури зберігання; 6) при використанні сухого льоду або рідкого азоту: технічна назва холодоагенту, відповідний номер ООН (UN 1845) та кількість нетто (кілограм, літрів); 7) маркувальні знаки, що попереджують про небезпеку та використовуються для інфекційних матеріалів категорії небезпеки A (додаток 11 до цього Порядку). 12. Для здійснення перевезень інфекційного матеріалу категорії небезпеки A на території України необхідні такі супровідні документи: 1) пакувальний лист/рахунок, який включає адресу отримувача, кількість упаковок, деталі вмісту, вагу та вартість; 2) транспортна накладна; 3) погодження маршруту руху транспортного засобу під час дорожнього перевезення небезпечних вантажів з Національною поліцією України відповідно до Порядку погодження та оформлення маршруту руху транспортного засобу під час дорожнього перевезення небезпечних вантажів, затвердженого наказом Міністерства внутрішніх справ України від 04 вересня 2018 року N 656, зареєстрованого в Міністерстві юстиції України 11 вересня 2018 року N 1043/32495; 4) детальний опис вмісту, який розміщується між вторинною та зовнішньою тарами. Якщо інформація про те, які інфекційні матеріали транспортуються, відсутня, необхідно вказати "імовірно інфекційні матеріали категорії небезпеки A". VI. Вимоги до пакування, маркування та супровідної документації інфекційного матеріалу категорії небезпеки B1. Інфекційний матеріал категорії небезпеки B, позначений під номером ООН UN 3373, транспортується за умов потрійного пакування, що відповідає специфікації підкласу 6.2 ООН та вимогам цього Порядку. Зразок пакування інфекційного матеріалу категорії небезпеки B наведено в додатку 8 до цього Порядку. 2. Первинна ємність з інфекційним матеріалом категорії небезпеки B розміщується у вторинну тару таким чином, щоб при транспортуванні виключити можливість їх витоку у вторинну тару. Первинна ємність або вторинна тара повинні витримувати перепад тиску щонайменше 95 кПа (0,95 бар) та зміни температури в діапазоні від -40 C° до +55 C°. Вторинна тара розміщується у зовнішню тару з використанням амортизуючого матеріалу. Вторинна та/або зовнішня тара мають бути виготовлені з жорсткого матеріалу. Для здійснення міжнародних перевезень обов'язковим є застосування жорсткої зовнішньої тари. 3. При транспортуванні рідких інфекційних матеріалів категорії небезпеки B первинна ємність та вторинна тара мають бути герметичні. Між первинною ємністю та вторинною тарою розташовується абсорбуючий матеріал у кількості, достатній для поглинання всього вмісту. Якщо в одній вторинній тарі знаходяться декілька первинних ємностей, в такому випадку кожна первинна ємність обгортається окремо або розділяється в окремі вторинні тари, щоб унеможливити контакт між ними. 4. При транспортуванні інфекційного матеріалу категорії небезпеки B в охолодженому чи замороженому вигляді, звичайний лід, сухий лід та інші охолоджуючі елементи розташовуються навколо вторинної тари (вторинних тар) або всередині зовнішньої тари. Для недопущення зміщення вторинної тари (вторинних тар) після розтанення звичайного льоду чи випаровування сухого льоду, застосовуються внутрішні кріплення. При використанні сухого льоду, зовнішня тара обладнується таким чином, щоб забезпечити вихід газоподібного двоокису вуглецю (вуглекислого газу), що випаровується. Первинна ємність та вторинна тара мають зберігати свою цілісність при температурі використовуваної охолоджувальної речовини. 5. Інфекційний матеріал категорії небезпеки B, що транспортується в рідкому азоті, розміщується у первинну ємність виготовлену з пластмаси, яка здатна витримати дуже низьку температуру. Первинна ємність та вторинна тара мають зберігати свою цілісність при температурі рідкого азоту. 6. На зовнішній тарі розміщується маркування з інформацією про вміст вантажу і характер небезпечного матеріалу. Інформація щодо дотримання стандартів упаковки (випробування упаковки) не потрібна. 7. Усі маркування на зовнішній тарі розташовуються таким чином, щоб їх було добре видно і щоб одні маркувальні знаки не були заклеєні іншими етикетками. VII. Забезпечення умов безпеки у разі виникнення аварійних ситуацій при транспортуванні інфекційних матеріалів1. Персонал суб'єкта господарювання, який здійснює транспортування інфекційного матеріалу, проходить навчання з метою недопущення виникнення аварійної ситуації з вивільненням у навколишнє природнє середовище інфекційного матеріалу. 2. Для ліквідації аварійної ситуації на території України персонал суб'єкта господарювання має вміти проводити такі процедури: 1) надягти рукавички та захисний одяг, в тому числі при необхідності захисний щиток або окуляри для захисту очей; 2) накрити вивільнений інфекційний матеріал шматком тканини або паперовим рушником для унеможливлення подальшого розповсюдження інфекційного матеріалу; 3) налити на тканину або паперовий рушник відповідний дезінфікуючий засіб для того щоб повністю покрити ділянку ураження та навколишню область (зазвичай використовують 5 % розчину гіпохлориту натрію); 4) наливати дезінфікуючий розчин слід концентричними колами, починаючи із зовнішньої зони матеріалів, що пролилися та поступово наближаючись до центру ураженої ділянки; 5) приблизно через 30 хвилин необхідно видалити всі матеріали. Якщо є уламки скляного посуду або інші гострі уламки, збирати їх необхідно за допомогою совка для сміття чи щільного картону і помістити в міцний контейнер для сміття; 6) надати постраждалій особі першу допомогу, в тому числі промити та продезінфікувати уражену ділянку тіла (при необхідності повторити процедуру 2 - 5 разів); 7) помістити контаміновані матеріали в герметичний міцний контейнер для сміття; 8) після завершення дезінфекції необхідно повідомити про випадок та прийняті міри головну експертну установу у сфері громадського здоров'я та Держпродспоживслужбу (у разі виникнення аварійної ситуації з інфекційним матеріалом категорії небезпеки A). В. о. Директора Департаменту
громадського здоров'я | Тетяна СКАПА |
Додаток 1
до Порядку обліку, зберігання, транспортування біологічно патогенних агентів
(пункт 6 розділу II)
Паспорт біологічно патогенного агента1. Найменування суб'єкта господарювання, що направив штам/культуру
_____________________________________________________________________________________ 2. Назва штаму/культури __________________________ N штаму/культури ____________________ 3. Мета дослідження (підтвердження/ідентифікація) ________________________________________ 4. Виділений від (вказати джерело виділення) ______________________________________________ 5. Дата відбору матеріалу _______________________________________________________________ 6. Дата виділення штаму/культури _______________________________________________________ 7. Матеріал або субстрат, з якого виділено штам ___________________________________________ 8. Ким виділено штам (назва суб'єкта господарювання та лабораторії) _________________________ 9. Дата відправлення штаму/культур _____________________________________________________ 10. Штам виділено: під час спалаху, при спорадичній захворюваності (потрібне підкреслити) Характеристика штаму/культури 11. Морфологія, фарбування ____________________________________________________________ 12. Культуральні ознаки ________________________________________________________________ 13. Біохімічні властивості _______________________________________________________________ 14. Серологічні властивості _____________________________________________________________ 15. Чутливість до антибіотиків (зона затримки та інтерпретація) ______________________________ 16. Генетичні особливості штаму ________________________________________________________ Додаткові дані: 17. __________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________ Завідувач лабораторії (власне ім'я, прізвище, по батькові (за наявності), підпис) _________________
_____________________________________________________________________________________ Телефон/e-mail ________________________________________________________________________ |
____________ Додаток 2
до Порядку обліку, зберігання, транспортування біологічно патогенних агентів
(підпункт 2 пункту 7 розділу II)
Інвентарний журнал обліку біологічно патогенних агентівN з/п | Назва штаму | Номер штаму | Дата надходження | Звідки надійшов | Місце виділення | Джерело виділення | Дата виділення | Ким виділено (П. І. Б., посада) | Примітка | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
____________ Додаток 3
до Порядку обліку, зберігання, транспортування біологічно патогенних агентів
(підпункт 4 пункту 7 розділу II)
Журнал передачі біологічно патогенних агентів іншому суб'єкту господарюванняN з/п | Дата надходження запиту | Звідки надійшов запит (найменування суб'єкта господарювання) | Назва БПА, кількість відпущених ємностей | Дата фактичної передачі | Інформація про відповідальну особу отримувача (П. І. Б., реквізити документа, що посвідчує особу, інформація про документ, що підтверджує повноваження, контактний номер телефону) | Підпис відповідальної особи отримувача БПА | Підпис відповідальної особи суб'єкта господарювання, який фактично здійснив передачу БПА | Примітки | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
____________ Додаток 4
до Порядку обліку, зберігання, транспортування біологічно патогенних агентів
(підпункт 6 пункту 7 розділу II)
Журнал записів результатів перевірки властивостей біологічно патогенних агентівN з/п | Назва матеріалу | N за інвентарною книгою | Дата досліду | Морфологічні властивості | Культуральні властивості | Біохімічні властивості | Серологічні властивості | Вірулентні властивості та імунологічні | Підпис відповідальної особи | Примітки | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
____________ Додаток 5
до Порядку обліку, зберігання, транспортування біологічно патогенних агентів
(пункт 10 розділу II)
Акт
видалення біологічно патогенного агенту 3, 4 груп небезпекиНами, ________________________________________________________________________________
(посада, прізвище, власне ім'я, по батькові (за наявності))
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
(причина знищення)
_____________________________________________________________________________________
видалено БПА ________________________________________________________________________
(N штаму, назва культури, кількість об'єктів)
_____________________________________________________________________________________
автоклавуванням ______________________________________________________________________
(режим автоклавування) Або
інсенерація ___________________________________________________________________________
_____________________________________________________________________________________
(при температурі C) Дата видалення: ____________ |
________________________
Підпис | | ________________________________
(власне ім'я, ПРІЗВИЩЕ) | ________________________
Підпис | | ________________________________
(власне ім'я, ПРІЗВИЩЕ) | ________________________
Підпис | | ________________________________
(власне ім'я, ПРІЗВИЩЕ) |
____________ Додаток 6
до Порядку обліку, зберігання, транспортування біологічно патогенних агентів
(пункт 9 розділу III)
Перелік біологічно патогенних агентів для людини (категорія небезпеки A)Номер ООН назва вантажу | Мікроорганізм | 1 | 2 | UN 2814
Інфекційний матеріал, небезпечний для людей | Bacillus anthracis (тільки культура)
Brucella abortus (тільки культура)
Brucella melitensis (тільки культура)
Brucella suis (тільки культура)
Burkholderia mallei - Pseudomonas mallei - Glanders (тільки культура)
Burkholderia pseudomallei - Pseudomonas pseudomallei (тільки культура)
Chlamydia psittaci - avian strains (тільки культура)
Clostridium botulinum (тільки культура)
Coccidioides immitis (тільки культура)
Coxiella burnetti (тільки культура)
Crimean-Congo haemorrhagic fever virus
Dengue virus (тільки культура)
Eastern equine encephalitis virus (тільки культура)
Escherichia coli, verotoxigenic (тільки культура)
Ebola virus
Flexal virus
Francisella tularensis (тільки культура)
Guanarito virus
Hantaan virus (тільки культура)
Hantaviruses causing haemorrhagic fever with renal syndrome
Hendra virus
Hepatitis B virus (тільки культура)
Herpes B virus (тільки культура)
Highly pathogenic avian influenza virus (тільки культура)
Human immunodeficiency virus (тільки культура)
Japanese encephalitis virus (тільки культура)
Junin virus
Kyasanur Forest disease virus
Lassa virus
Machupo virus
Monkeypox virus
Mycobacterium tuberculosis (тільки культура)
Nipah virus
Omsk haemorrhagic fever virus
Poliovirus (тільки культура)
Rabies virus (тільки культура)
Rickettsia prowazekii (тільки культура)
Rickettsia rickettsii (тільки культура)
Rift Valley fever virus (тільки культура)
Russian spring-summer encephalitis virus (тільки культура)
Sabia virus
Shigella dysenteriae type 1 (тільки культура)
Tick-borne encephalitis virus (тільки культура)
Variola virus
Venezuelan equine encephalitis virus (тільки культура)
West Nile virus (тільки культура)
Yellow fever virus (тільки культура)
Yersinia pestis (тільки культура) | UN 2900
Інфекційний матеріал, небезпечний тільки для тварин | African swine fever virus (тільки культура)
Avian paramyxovirus type 1 - velogenic Newcastle disease virus (тільки культура)
Classical swine fever virus (тільки культура)
Foot-and-mouth disease virus (тільки культура)
Goatpox virus (тільки культура)
Lumpy skin disease virus (тільки культура)
Mycoplasma mycoides - contagious bovine pleuropneumonia (тільки культура)
Peste des petits ruminants virus (тільки культура)
Rinderpest virus (тільки культура)
Sheep pox virus (тільки культура)
Swine vesicular disease virus (тільки культура)
Vesicular stomatitis virusBacillus anthracis (тільки культура) |
____________ Додаток 7
до Порядку обліку, зберігання, транспортування біологічно патогенних агентів
(пункт 2 розділу V)
Зразок пакування та маркування інфекційного матеріалу категорії A 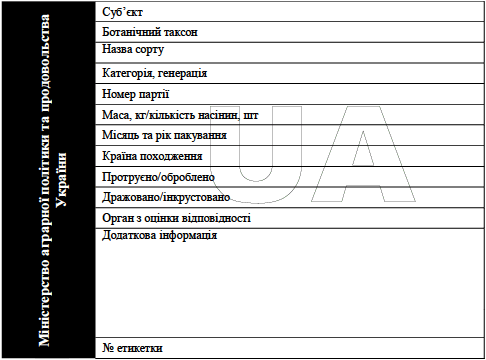 ____________ Додаток 8
до Порядку обліку, зберігання, транспортування біологічно патогенних агентів
(пункт 1 розділу VI)
Зразок пакування та маркування біологічно патогенних агентів категорії небезпеки B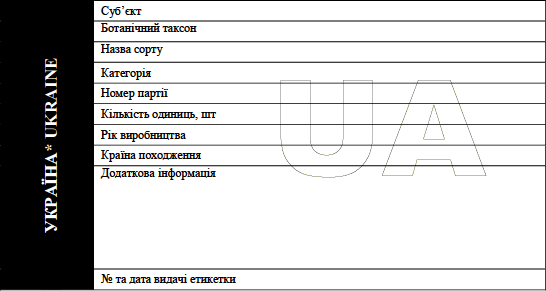
____________ Додаток 9
до Порядку обліку, зберігання, транспортування біологічно патогенних агентів
(пункт 11 розділу III)
Зразок пакування та маркування інфекційного матеріалу із застосування сухого льоду  ____________ Додаток 10
до Порядку обліку, зберігання, транспортування біологічно патогенних агентів
(пункт 6 розділу IV)
Зразок пакування та маркування транспортної тари  ____________ Додаток 11
до Порядку обліку, зберігання, транспортування біологічно патогенних агентів
(підпункт 7 пункту 11 розділу V)
Маркувальні знаки, що попереджають про небезпекуІнфекційний матеріал категорії A | Маркувальний знак (зовнішня тара) | Найменування знаку | Застосування | Мінімальні розміри | Кількість етикеток на тарі | Колір | 1 | 2 | 3 | 4 | 5 | 6 |  | "ІНФЕКЦІЙНИЙ МАТЕРІАЛ" | для інфекційного матеріалу категорії A та БПА, які відповідають визначенню інфекційних матеріалів категорії A | 100 мм × 100 мм (для дрібних упаковок: 50 мм × 50 мм) | 1 | чорно-білий |  | інші небезпечні матеріали | для твердого окису вуглецю (сухого льоду) (UN 1845) | 100 мм × 100 мм (для дрібних упаковок: 50 мм × 50 мм) | 1 | чорно-білий | 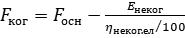 | негорючий нетоксичний газ | для матеріалу, запакованого з використанням рідкого азоту | 100 мм × 100 мм (для дрібних упаковок: 50 мм × 50 мм) | 1 | зелений та білий чи зелений та чорний | 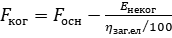 | кріогенна рідина | для кріогенної рідини | стандарт А7: 74 мм × 105 мм | 1 | зелений та білий |  | орієнтуюча наклейка, маніпуляційний знак "Верх" | для зазначення правильного положення кришки первинного контейнера | стандарт А7: 74 мм × 105 мм | 2 на протилежних сторонах | чорно-білий або червоний та білий | Інфекційний матеріал категорії B | Маркувальний знак (зовнішня тара) | Найменування знаку | Застосування | Мінімальні розміри | Кількість етикеток на тарі | Колір |  | "БІОЛОГІЧНИЙ МАТЕРІАЛ, КАТЕГОРІЯ В" | для інфекційного матеріалу категорії B та БПА, які відповідають визначенню інфекційних матеріалів категорії B | 50 мм × 50 мм | 1 | не регламентований; чорно-білий |  | інші небезпечні матеріали | для твердого окису вуглецю (сухого льоду) (UN 1845) | 100 мм × 100 мм (для дрібних упаковок: 50 мм × 50 мм) | 1 | чорно-білий |  | негорючий нетоксичний газ | для матеріалу, запакованого з використанням рідкого азоту | 100 мм × 100 мм (для дрібних упаковок: 50 мм × 50 мм) | 1 | зелений та білий чи зелений та чорний |  | кріогенна рідина | для кріогенної рідини | стандарт А7: 74 мм × 105 мм | 1 | зелений та білий |  | орієнтуюча наклейка, маніпуляційний знак "Верх" | для зазначення правильного положення кришки первинного контейнера | стандарт А7: 74 мм × 105 мм | 2 на протилежних сторонах | чорно-білий або червоний та білий |
____________ |